М. В. Джеквуд, Департамент здравоохранения населения
Лаборатория диагностики и исследований птицы
Колледж ветеринарной медицины Университета Джорджии Афины GA 30602, США
АННОТАЦИЯ
Вирус инфекционного бронхита кур (IBV), как все короновирусы, представляет собой оболочечный РНК-вирус, который вызывает у цыплят высококонтагиозное заболевание верхних дыхательных путей. Поскольку РНК-вирусы по своей природе могут быстро мутировать, когда они реплицируются в хозяине, IBV существует в виде множества различных типов и вариантов этих типов, которые практически не имеют перекрестной реактивности. Следовательно, вакцина, разработанная против одного типа вируса, скорее всего, не обеспечит адекватную защиту против другого типа. Первоначально IBV был типирован в реакциях нейтрализации специфическими вируснейтрализующими антителами, однако теперь тип IBV идентифицируется генетически с использованием последовательности поверхностного шипового гликопротеина вируса.
Генетическое типирование полевых изолятов вируса может помочь в выборе одной или нескольких коммерчески доступных вакцин для профилактики и контроля распространения заболевания, учитывая, что выбор гомологичной вакцины против циркулирующего вируса является наилучшей стратегией успеха. Если гомологичная вакцина недоступна, то комбинация нескольких типов вакцин против IBV иногда может обеспечить приемлемую защиту с целью уменьшения репликации полевого вируса, чтобы можно было предотвратить или минимизировать его передачу. Был проведен ряд исследований, посвященных изучению различных комбинаций типов IBV-вакцин против различных штаммов вирусов.
ВСТУПЛЕНИЕ
Инфекционный бронхит кур встречается во всем мире и является экономически значимым заболеванием, которое ежегодно обходится индустрии в миллионы долларов из-за сокращения производительности, выбраковки при переработке и смертности. Этиологическим агентом является вирус инфекционного бронхита кур (IBV), оболочечный одноцепочечный РНК-вирус с положительно полярной нитью, вызывающий высококонтагиозное заболевание верхних дыхательных путей у кур. В настоящее время лучшей и единственной стратегией борьбы с IBV является использование ослабленных живых и инактивированных вакцин (6). Как правило, живые вакцины вводятся бройлерам в возрасте одного дня в инкубатории, а иногда и в полевых условиях в возрасте от 14 до 18 дней. Инактивированные вакцины против IBV, необходимо вводить после обязательной первичной вакцинации живой вакциной племенным птицам или несушкам для обеспечения длительного иммунитета. Независимо от типа используемой вакцины, сложно обеспечить полноценную защиту, потому что разные типы IBV не обеспечивают перекрестную защиту. Кроме того, должное применение живых и инактивированных вакцин является весьма проблематичным, а неправильное использование оборудования, обращение с вакциной, неправильная техника введения и снижение дозы могут привести к увеличению распространения вируса на предприятиях.
Целью вакцинации против IBV является предотвращение клинических признаков заболевания, но также важно уменьшить репликацию вируса и его последующую передачу. Как и все позитивные РНК-вирусы, IBV обладает огромной способностью развивать генетическое разнообразие, когда он размножается. Коронавирусы — это одноцепочечные РНК-вирусы с положительно полярной нитью. Очень большой вирусный геном (~ 32Kb) кодирует РНК-зависимую РНК-полимеразу вируса (RdRp, гены 1a и 1ab), 4 структурных белка (Spike [S], Membrane [M], Envelope [E] и Нуклеокапсид [N]) и многочисленные регуляторные белки.
Диагностика IBV выполняется с использованием молекулярных методов. Вирусная РНК может быть обнаружена с помощью обратной транскрипции с полимеразной цепной реакцией и ОТ-ПЦР в реальном времени. Тесты предназначены для выявления всех штаммов IBV с последующим секвенированием гена S1 для определения генетического типа или ПЦР в реальном времени по конкретным типам. Определение текущего типа (ов) IBV, циркулирующих в окружающей среде, необходимо для выбора эффективных вакцин и разработки соответствующих стратегий вакцинации для борьбы с вирусом.
ВАРИАНТЫ IBV
Генетическое разнообразие среди штаммов IBV генерируется посредством мутаций, вставок и случаев рекомбинации при репликации вируса. У очень большого вирусного генома частота мутаций достигает 1,2 × 103 прайм / сайт / год. Этот высокий уровень мутации способствует появлению множества вариантов вируса в циркуляции. S-гликопротеин является наиболее изученным структурным белком, обнаруженным в коронавирусах. Гликопротеин S состоит из двух субъединиц, обозначенных S1 и S2, и образует выступы в форме шипов на поверхности вирусных частиц (2). Субъединица S1 опосредует прикрепление клетки-хозяина и по большей части отвечает за специфичность клетки-хозяина.
Кроме того, нейтрализующие антитела направлены против субъединицы S1 (1). Субъединица S2 закреплена в оболочке вируса и нековалентно связана с S1. Антигенное разнообразие (штаммы вируса) генерируется, когда в гене спайка происходят мутации, вставкии рекомбинации. Это может привести к значительному различию шипа на поверхности вируса и, следовательно, к новому генетическому и антигенному типу IBV. Обзор литературы выявил ряд вирусов с признаками рекомбинации, но в целом новые типы IBV почти всегда появляются в результате мутаций в S, накапливающихся с течением времени и называемых дрейфом генов. Когда вирус может свободно размножаться и передаваться не защищенным или частично защищенным птицам, мутации накапливаются, и, в дальнейшем, будут сохраняться. Если мутации находятся в гене S, результатом будет в конечном итоге появление нового штамма IBV.
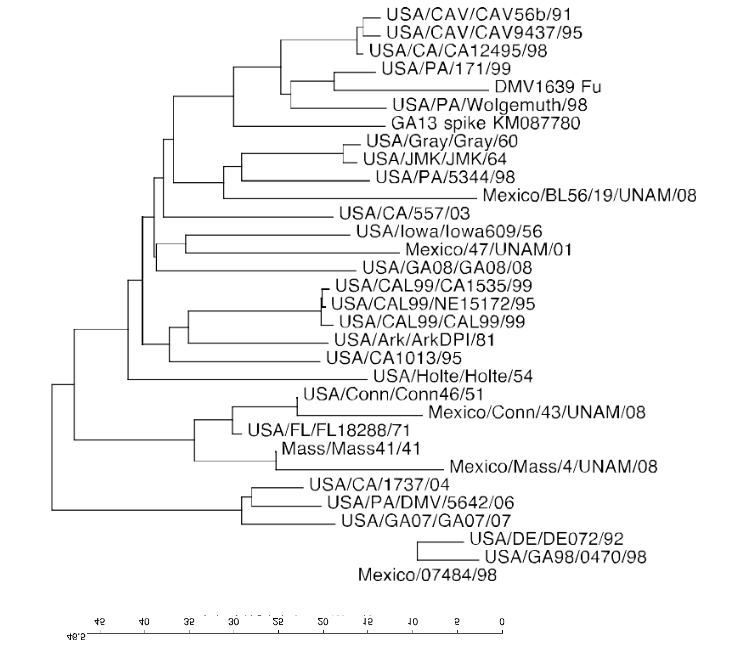
Некоторые из важных штаммов IBV в США и Мексике перечислены в Таблице 1, и их связь друг с другом в гликопротеине S1 можно увидеть в филогенетическом дереве на Рисунке 1. В США преобладающие вирусы, циркулирующие в коммерческой домашней птице, это GA08, GA13 и DMV / 1639. Типы Арканзас и Масса также изолированы, но они в значительной степени связаны с вакцинами. В Мексике самые последние сообщения о штаммах IBV в литературе и в GenBank (www.ncbi.nlm.nih.gov) относятся к типам IBV, выделенным между 1998 и 1999 годами, 20 лет назад. Эти вирусы генетически связаны с Conn, Mass, Mexico / 1765/99 (аналогично Mexico / 7277/99 в таблице 1) и BL56 / 96.
IBV И ТРАНСМИССИЯ
Чтобы разработать эффективную стратегию вакцинации для борьбы с IBV, необходимо знать, какие штаммы вируса циркулирует в популяции коммерческой птицы. Также важно поддерживать своевременную программу эпиднадзора для отслеживания этого постоянно меняющегося вируса, чтобы вакцины могли быть соответствующим образом обновлены. Эффективная вакцинация против IBV значительно снижает репликацию вируса и останавливает передачу вируса. Среднее число новых инфекций, вызванных одной инфицированной особью (R0), для IBV оно составляет 19,95. Это означает, что 1 зараженный цыпленок может распространить вирус почти на 20 восприимчивых цыплят. Однако R0 для полностью защищенной курицы составляет 0,69 (4). Однако, когда R0 больше 1, вспышка заболевания продолжит распространяться; когда R0 меньше 1, вспышка исчезнет. Следовательно, вакцинация имеет два важных результата. Она снижает R0 до числа менее 1, чтобы вспышка заболевания не распространялась, и она уменьшает репликацию вируса, тем самым уменьшая вероятность появления новых вирусов.
IBV контроль
Отсутствие защиты или частичная защита от циркулирующих вирусов не является редкостью и может быть связано с плохой перекрестной защитой после используемых вакцин или неправильной техникой вакцинации. Кроме того, вакцины при неправильном применении могут сохраняться в стаде и потенциально стать вирулентными. Хорошо известно, что IBV с совершенно разными белками шипов не защищают перекрестно и что гомологичные аттенуированные живые вакцины обеспечивают наилучшую защиту (6). Однако у нас нет гомологичных аттенуированных живых вакцин для всей разновидности штаммов IBV, обнаруженных у цыплят. Тип IBV определяется перекрестно-реактивными нейтрализующими антителами (серотип), последовательностью белка S1 (генетический тип) или перекрестной защитой у цыплят (прототип). Большинство диагностических исследований в настоящее время определяют генетический тип вируса, а генетический тип по большей части коррелирует с серотипом. Однако, как правило, перекрестная защита уменьшается с уменьшением процентного сходства в последовательности белка S1; было показано, что некоторые типы вакцин обеспечивают лучшую перекрестную защиту, чем другие. Вероятно, степень консервативных областей в белке шипа между различными типами IBV способствует перекрестной защите. Кроме того, сила иммунного ответа также может способствовать перекрестной защите, а количество полученных вакцин и комбинация различных типов вакцин против IBV могут максимизировать выработку перекрестно-защитных антител. Следует признать, что перекрестная защита у кур не может быть предсказана с определенной уверенностью и должна быть проверена in vivo (3).
Разработка стратегии вакцинации как гомологичными типами вакцин, так и в комбинации с гетерологичными вакцинами, вводимыми многократно, является важным инструментом контроля IBV, потому что это может снизить репликацию циркулирующего вируса ниже уровня передачи, предотвратить, или, по крайней мере, замедлить появление новых антигенных штаммов IBV, которые могут вызывать заболевание.
РЕЗЮМЕ
Коронавирус IBV распространен во всем мире и наносит значительный экономический ущерб. Борьба с IBV в значительной степени осуществляется с помощью живых аттенуированных и инактивированных вакцин, но вызвать защиту сложно, поскольку разные типы IBV не обеспечивают перекрестную защиту. Различные типы IBV генерируются, когда вирус реплицируется, и хотя рекомбинация может играть свою роль, по большей части репликация, приводящая к мутациям, делециям и вставкам в гене гликопротеинового шипа, накапливающимся со временем (генетический дрейф), чаще всего приводит к появление новых типов IBV. Вакцинация, если она проводится неправильно или используется неправильный тип вакцины или комбинация типов вакцин, обеспечивает лишь частичную защиту, которая позволяет циркулирующим вирусам продолжать реплицироваться и передаваться среди цыплят, обеспечивая возможность возникновения мутаций.
Если эти мутации происходят в гене S, они могут привести к появлению новых вариантов вирусов, потенциально способных вызвать заболевание. Ключом к программе контроля для IBV является широко распространенное и своевременное наблюдение. Знание штаммов IBV, циркулирующих в настоящее время в данной области, имеет решающее значение и будет гарантировать, что выбранные вакцины и программа вакцин являются наилучшей стратегией для борьбы с этим экономически важным заболеванием.
ЛИТЕРАТУРА
- Boursnell, M., M.M. Binns, T. Brown, D. Cavanagh and F.M. Tomley Molecular biology of avian infectious bronchitis virus. Karger, New York. 1989.
- Cavanagh, D. Coronavirus avian infectious bronchitis virus. Vet Res 38:281-297. 2007.
- Cook, J.K.A., Orbell, S. J., Woods, M. A., Huggins, M. B. Breadth of protection of the respiratory tract provided by different live-attenuated infectioius bronchitis vaccines against challenge with infectious bronchitis viruses of heterologous serotypes. Avian Pathology 28:477-485. 1999.
- de Wit, J.J., M.C. de Jong, A. Pijpers and J.H. Verheijden Transmission of infectious bronchitis virus within vaccinated and unvaccinated groups of chickens. Avian pathology : journal of the W.V.P.A 27:464-471. 1998.
- Jackwood, M.W. Review of infectious bronchitis virus around the world. Avian Dis 56:634- 641. 2012.
- Jackwood, M.W. and S. de Wit Infectious Bronchitis. In: Diseases of Poultry, 13 ed. D.E. Swayne, J.R. Glisson, L.R. McDougald, L.K. Nolan, D.L. Suarez and V. Nair, eds. John Wiley and Sons, Inc. pp 139-159. 2013.
Таблица 1. Некоторые важные типы IBVв США и Мексике
| Country | Strain | Type | GenBank# |
| United States of America | Ark/ArkDPI/81 | Arkansas | AF006624 |
| CA/557/03 | California | DQ912828 | |
| CA/1737/04 | California | DQ912830 | |
| CA/CAL99/CAL99/99 | Cal99 | DQ912831 | |
| CA/CAV/CV56b/91 | California | AF027509 | |
| Variant | |||
| Conn/Conn46/51 | Conn | L18990 | |
| DE/DE072/92 | Delaware | U77298 | |
| DMV/1639/14 | Delaware | KR232396 | |
| GA/GA11/124/11 | GA11 | NAβ | |
| GA/GA08/GA08/08 | GA08 | GU361606 | |
| GA/GA07/GA07/07 | GA07 | JN160805 | |
| GA/GA98/0470/98 | GA98 | AF274437 | |
| Mass/Mass41/41 | Mass | AY561711 | |
| PA/Wolgemuth/98 | Wolgemuth | AF305595 | |
| PA/171/99 | PA/171 | AF419314 | |
| Mexico | Mexico/Ark type | Arkansas | NA |
| Mexico/Conn/43/UNAM/08 | Conn | EU526403 | |
| Mexico/Mass/4/UNAM/08 | Mass | EU526411 | |
| Mexico/47/UNAM/01 | ? | EU526405 | |
| Mexico/7277/99 | ? | AF363596 | |
| Mexico/BL5619/UNAM/08 | BL56 | EU526407 | |
| Mexico/07484/98 | ? | AF288467 | |
| Mexico/UNAM97/97 | ? | NA |
Рис. 1 Филогенетическй анализ. показывающий генетическое взаимоотношение для протеина S1 среди штаммов IBV
Читайте также
Совместная образовательная программа «ЖИВОТНОВОДСТВО БУДУЩЕГО» компании MSD Animal Health и Центра развития здравоохранения Московской школы управления CКОЛКОВО
В октябре 2020 года компания MSD Animal Health совместно с Центром развития здравоохранения Московской школы управления СКОЛКОВО организовала образовательный курс «Животноводство Будущего». Двухнедельная образовательная программа была нацелена на руководителей и ключевых сотрудников предприятий-лидеров российской сельскохозяйственной отрасли. Вместе мы постарались найти ответы на вопросы: «какие изменения ждут животноводство в новом десятилетии?» и «что нужно, чтобы к ним подготовиться?»


